前回の説明で原子の構造、及び重要な原子のイオン状態を説明した。
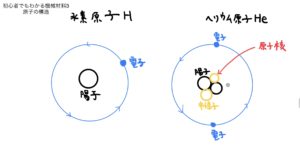
今回は、原子同士がどのように結合して分子となるのかを説明していく。
そもそも原子は、単体で存在していることは非常に稀で大抵はなんらかの複数の原子が結合して物質(分子)となり存在している。
特にイオン状態になりやすい原子については、電子殻は安定するものの電気的に釣り合っていないので非常に不安定な状態だ。
その電気的不釣り合いが原子の結合に大きな影響を与えるのだ。
また、今回で説明する結合の仕方によって物質の大まかな特性が決まるので、とても重要な項目になるので是非、理解して欲しい。
基本的な原子同士の結合の種類として金属結合、イオン結合、共有結合がある。
まずは、機械材料で頻繁に利用される金属の結合から説明していこう。
金属結合
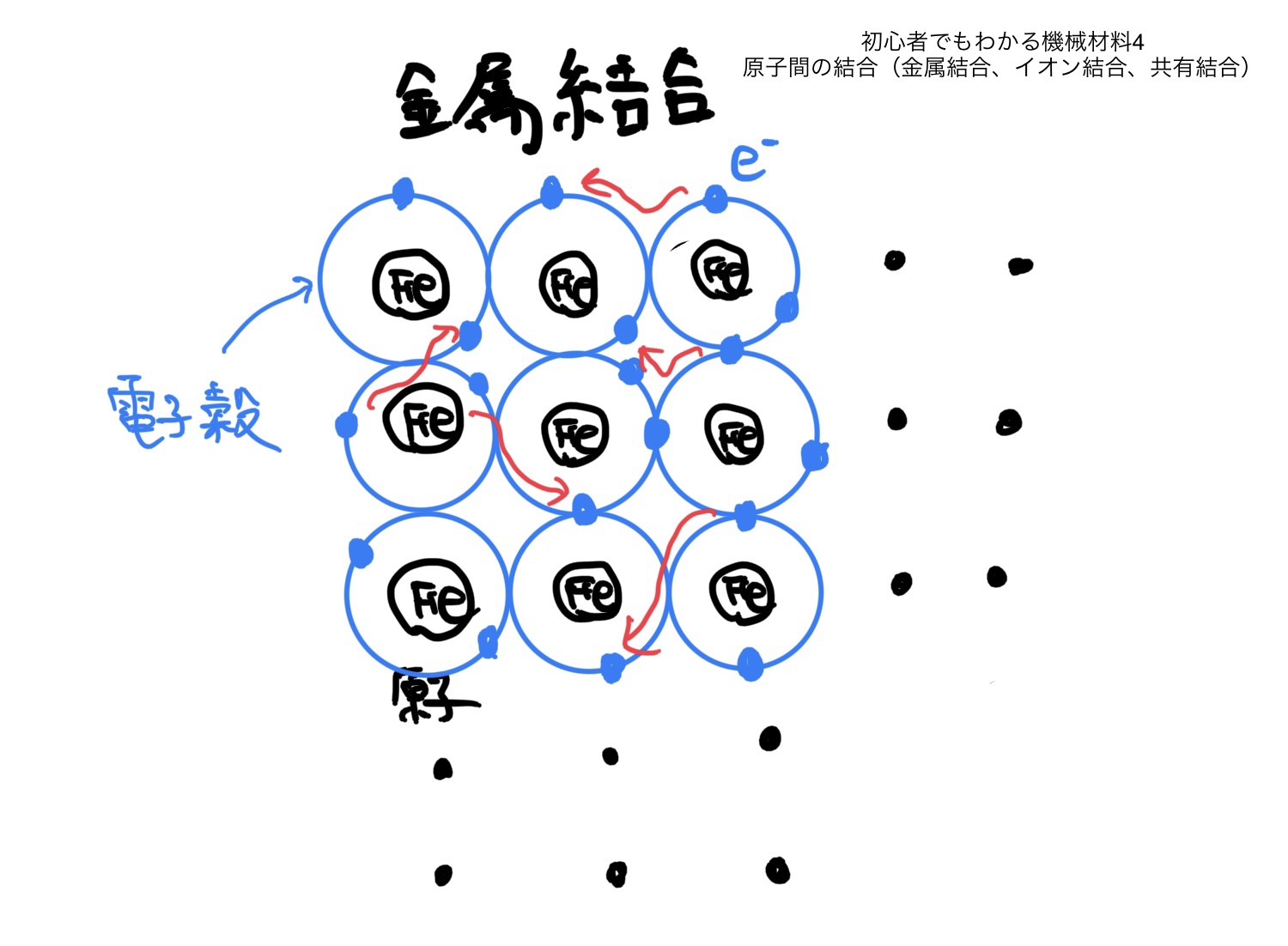
いきなり金属結合という言葉が出てきたが、この言葉の意味は簡単で単純に金属に多く見られる結合なので単純に金属結合と呼んでいる。
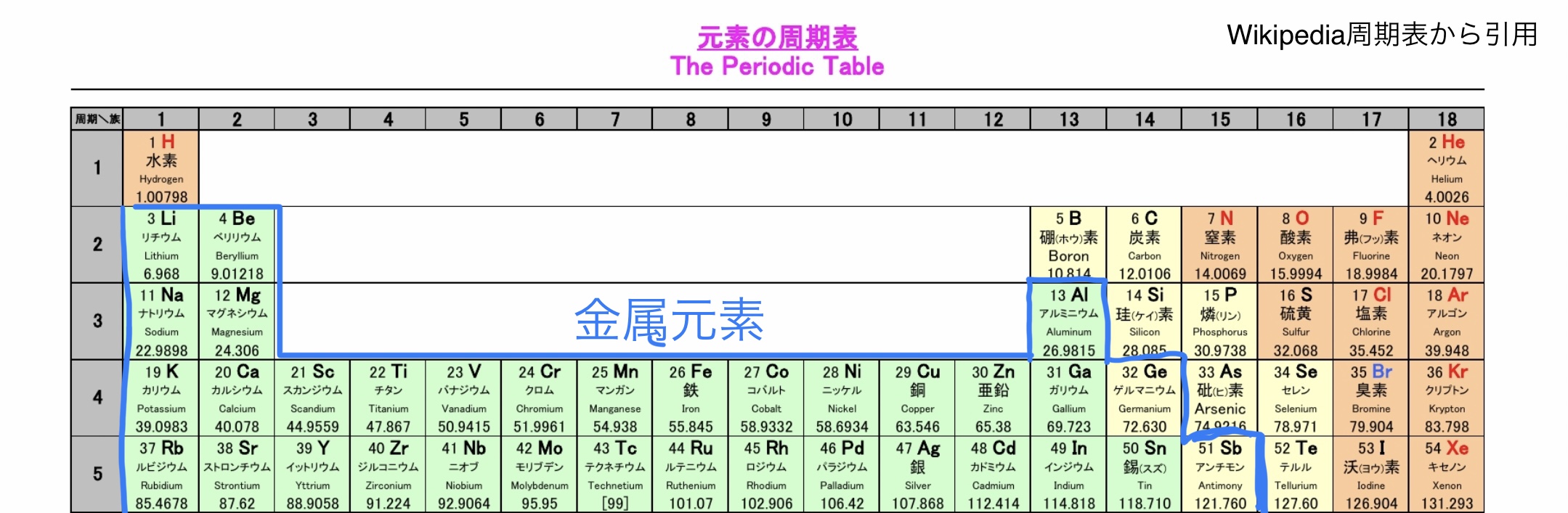
この金属結合のメカニズムを説明する前に“金属ってなんだっけ?“という方もいると思うので少し復習すると次の図にある材料が機械材料において代表的な金属になる。
化学の周期表で見れば次の図の青の枠で囲んだ元素が金属原子と呼ばれることが多い(化学での金属の定義は、難しくてよくわからなかった)。
ここで金属結合の説明にために代表的な金属である鉄Fe(原子番号26)、アルミAl(原子番号13)を例に考えていこう。
まず前回のおさらいになるが鉄、アルミが持つ電子の数はアルミAlが13個、鉄Feが26個になる。
それぞれの原子では、電子殻が閉殻していないので電子が余所とやりとりを行なってイオン状態になる。
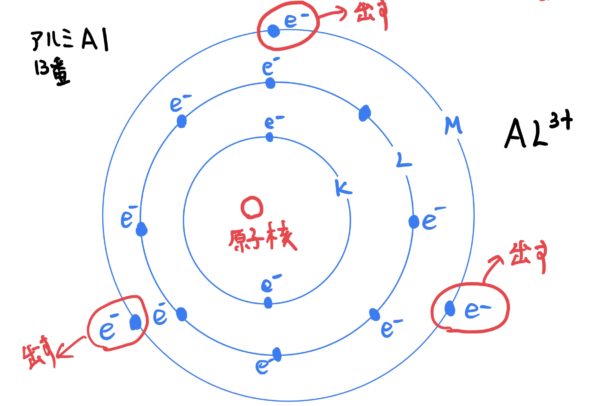
アルミALだと電子の数が13個なのでK殻2個、L殻8個、M殻3個の配列になりL殻で閉じようとするので3個の電子を余所に放り出すのでイオン状態は、$ Al^{3+}$と+イオン状態になる。
一方で鉄Feは、電子が26個あるのでK殻2個、L殻8個、M殻8個、N殻8個となると前回に説明したが鉄Feはちょっと特殊な電子の配置になっており、実はN殻に電子が2個入ると一度電子殻が安定してM殻に電子が入り始める。
その性質によって鉄の電子配置は、K殻2個、L殻8個、M殻8個、N殻2個から戻ってさらにM殻6個の電子が入る。
ここでまた特殊なことが起きてM殻の電子の数が8+6=14個で閉殻してしまうのだ。
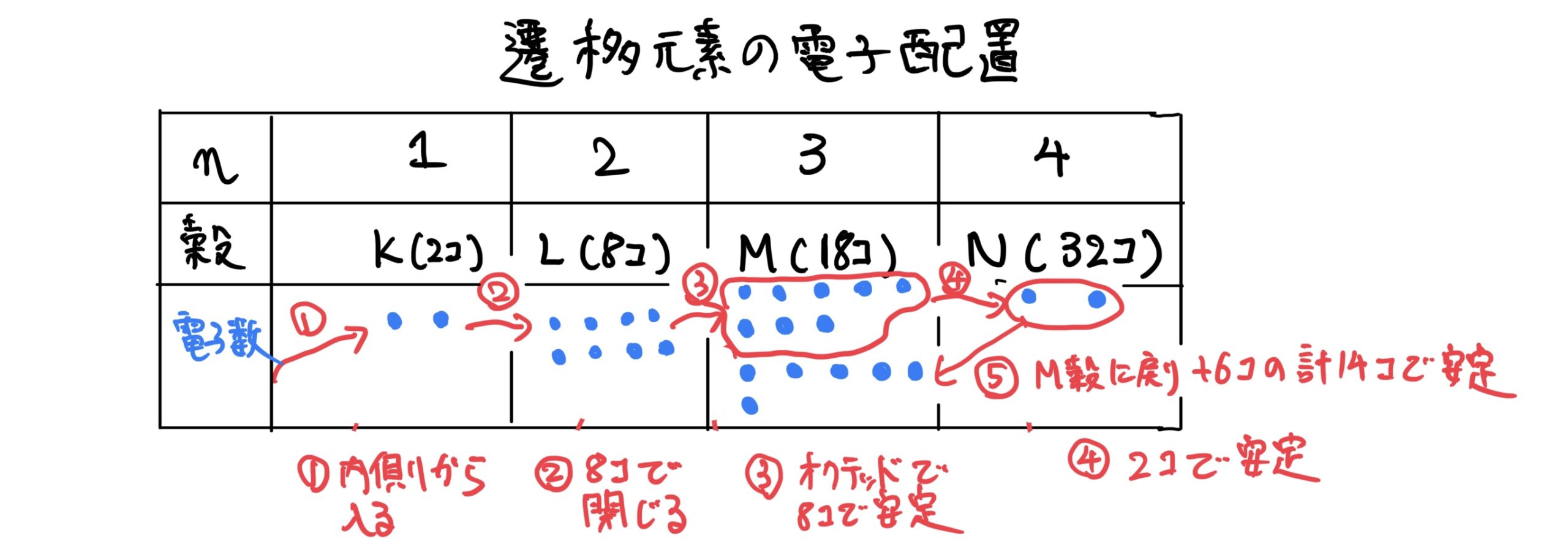
よって一番外側の電子軌道はN殻となり余分な電子が2個ほどあるので、それを余所に出そうとするので鉄のイオン状態は、$ Fe^{2+}$となる。
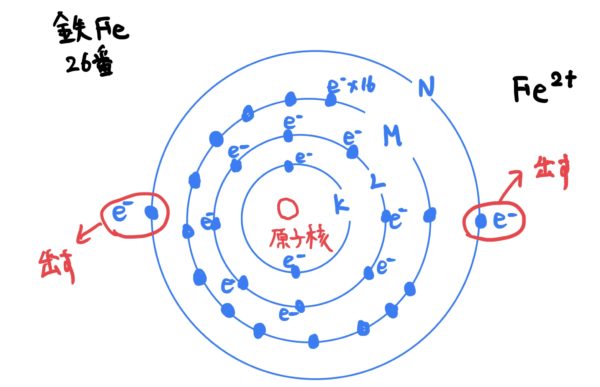
ちょっとややこしいが鉄のような特殊な電子の配置の仕方をする元素を遷移元素と呼び周期表では、次の赤い枠で囲んだ原子になる。
この遷移元素の電子配置の法則は量子力学を少し齧るとK、L、M・・・などの電子殻内にさらに電子殻がs、p、d・・・と分けられ、その中の入り方で説明できるのだが今回は、詳細は説明を省かせてもらう(要望があればやります)。
こんな感じで化学には例外が多いように筆者は感じて苦手意識を持っている。
いずれにせよ例にしたアルミAl、鉄Feが+イオン状態になるように多くの金属原子が+イオン状態になる。
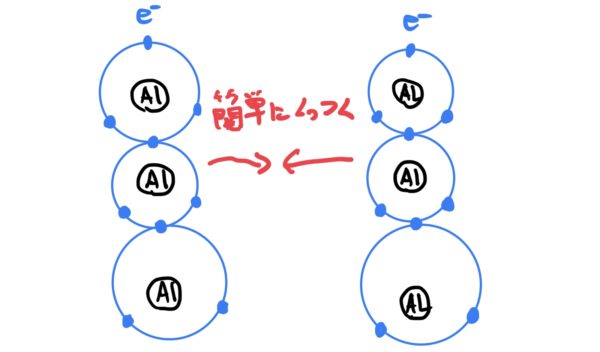
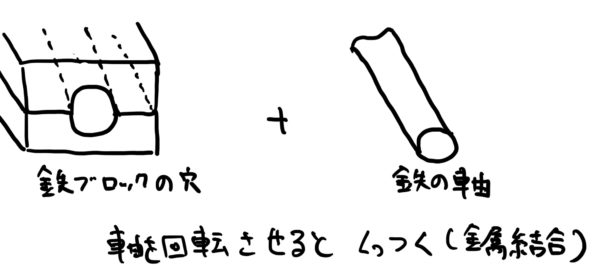
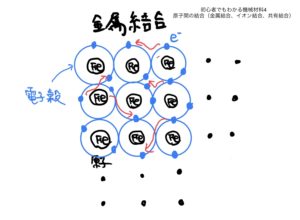
金属原子がイオン状態になったときに同じ金属原子が近くにあると、ある面白い現象が発生する。
それは、金属がイオン状態になると安定するため、余った電子を余所に出そうとする作用が各金属原子に働く。
そのときに余所に出した電子が他の同じ金属原子の電子と電子殻を共用し始めるのだ。
しかも面白いのが隣の金属原子の電子だけでなく物質全体の金属原子と共用するのだ。
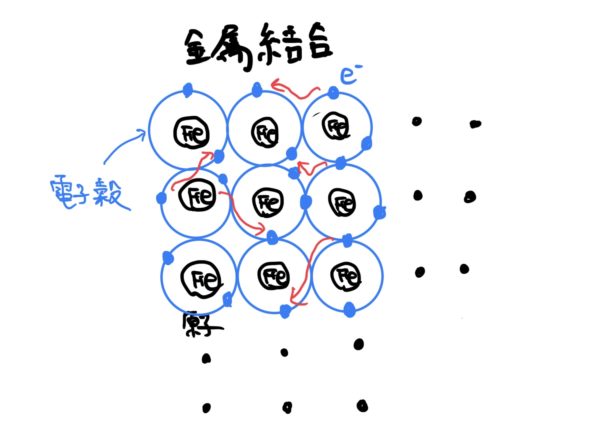
この電子が電子殻を共用する作用によって各金属原子が結合して物質になる。
これが金属結合のメカニズムだ。
金属結合の特徴
この結合の大切な特徴が物質全体で電子が電子殻を共用しているので一部が切断されても簡単に再結合できる。
この性質が金属の延性特性に繋がる。
また金属は、刃具などで加工しても容易に裂けることなどなく良好な加工性(結合力がほどほどの強さ)を持つのもこの結合による性質だ。
逆に再結合しやすい性質のため適切な設定で設計しないと同じ金属部品同士を摺動させるとすぐにくっついてしまう(凝着)ので注意が必要だ。
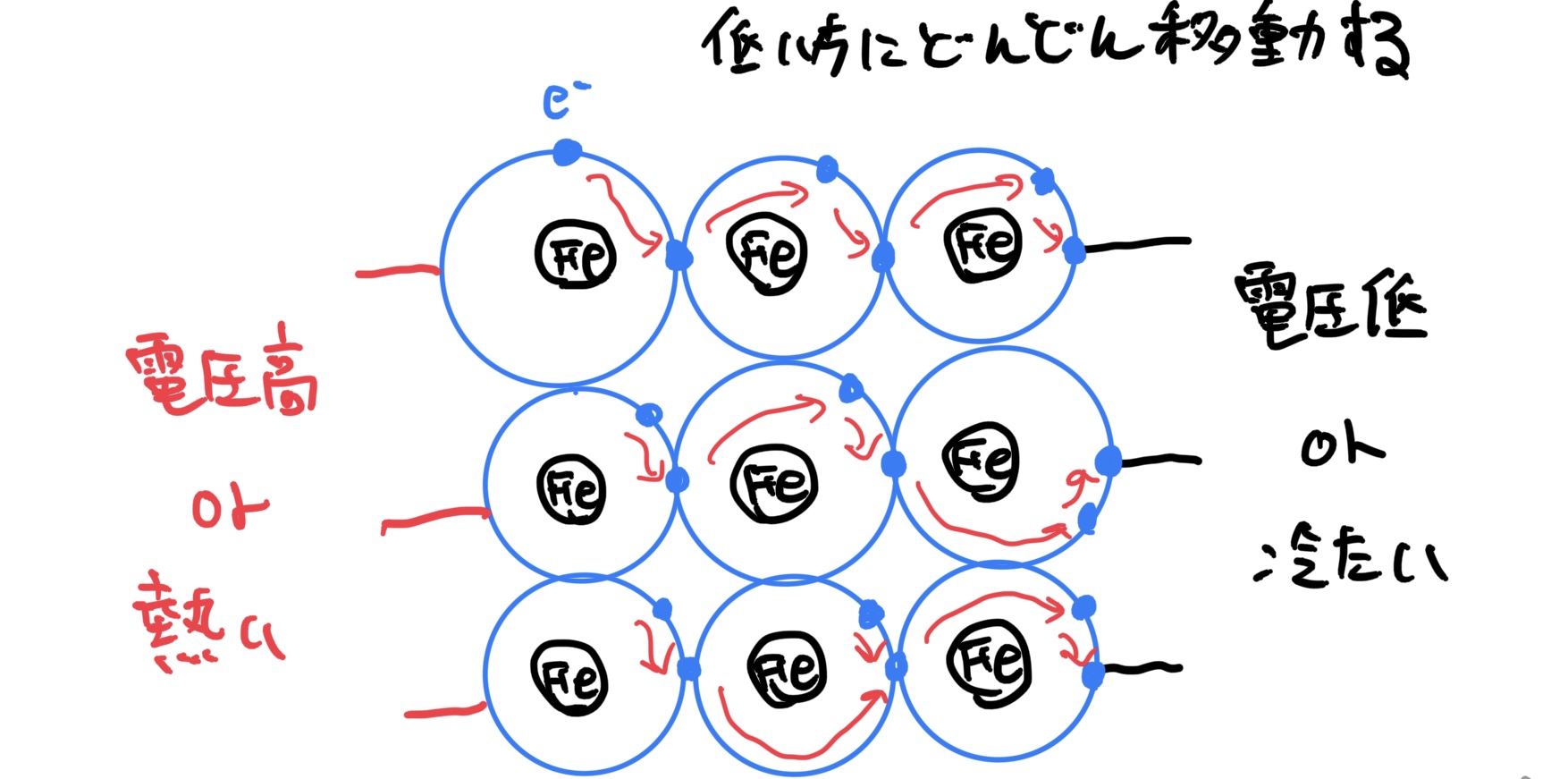
他にも重要な特性としては、物質全体で電子が電子殻を共有しているため電子が自由に物質全体を動き回っている。これにより電圧を与えれば容易に電気が流れるのだ(導電性が良い)。
さらに熱を加えた時も熱エネルギーが電子の運動エネルギーに置き換わって伝達されるので非常に良い熱伝導性を持つことが多い。
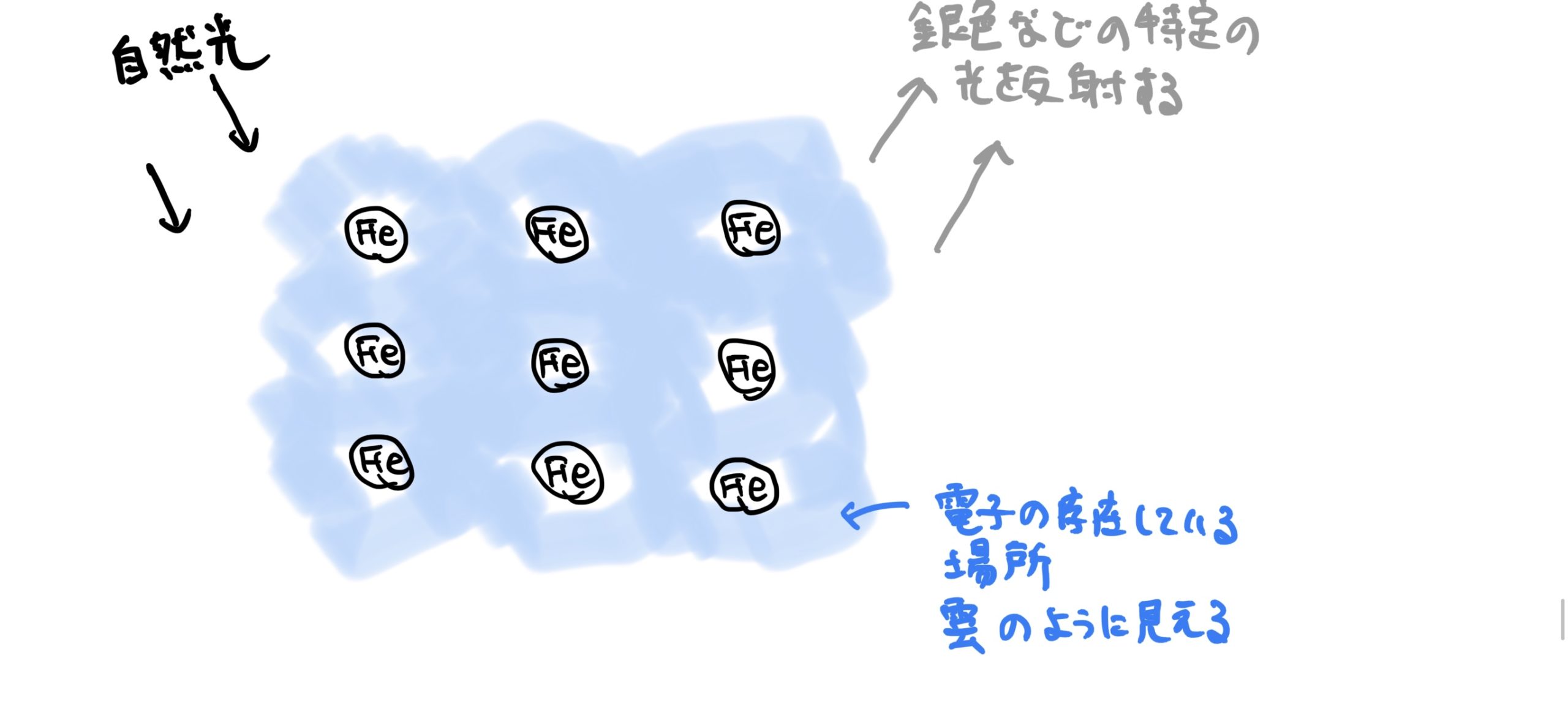
また電子顕微鏡で金属物質を覗くと多くの電子が共有した電子殻を動き回っているので物質全体に雲が掛かっておるように見える。
この雲が特定の光の波長を反射させるので金属物質は、キラキラと光沢があるように見えるのだ。
このように金属結合は、人間にとって非常に扱いやすい特性を持っている結合なのだ。
ちなみに金属結合の結合力は、これから説明するイオン結合、共有結合に比べると比較的に弱い結合力になる。
次に非金属に比較的多い結合のイオン結合と共有結合のイオン結合を説明する。
イオン結合
イオン結合は、理解するのがとても簡単だ。
まずイオン状態になった原子は、電子を余所に出したり貰ったりすることで原子の電気的釣り合いが崩れてそれぞれ+やーの電荷を持つ。
このときにお互いの原子の電荷が+と−が同じ量であれば原子どうしに静電気力が働いてくっつく作用が発生する。
この静電気力によって結合することをイオン結合と呼ぶ。
このイオン結合は金属原子と非金属原子を結合するときに多くみられる。
例えばイオン結合の典型例として金属原子であるナトリウムNa(原子番号11)と非金属原子である塩素Cl(原子番号17)でそれぞれイオン状態になるとナトリウ$ Na^+ $で塩素が$ Cl^- $となりお互いの原子が電気的に+と−になり静電気力が働いて結合する。
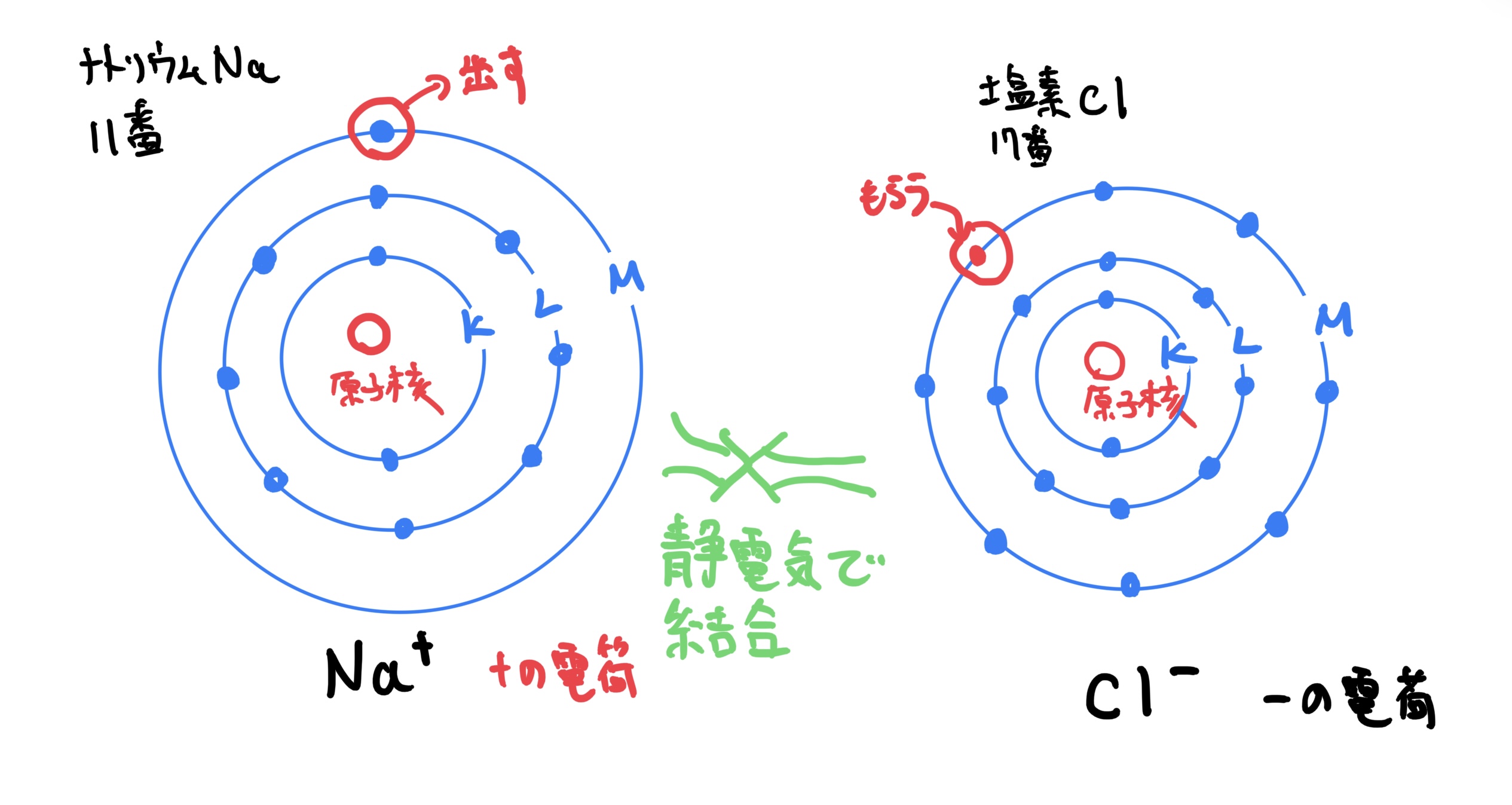
この結合でできる物体が塩化ナトリウムNaClで皆さんがよく知っている塩になる。
イオン結合の特徴
このイオン結合の特徴としては、電気的釣り合いが取れているので基本的に導電性が良くない。
しかし水のような溶液に溶かして水溶液にすると液体の中で物質がイオン状態になりやすく電子が自由に動けるようになるので水溶液の状態では電動性が良い。
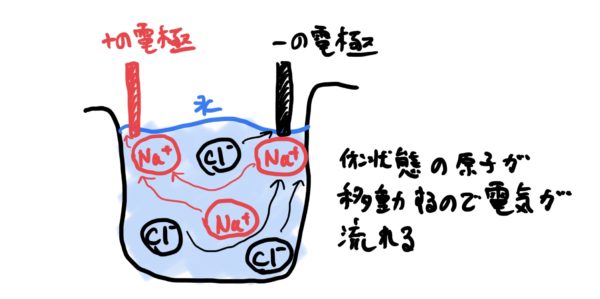
典型的な例は、海水などの塩水が電気をよく通すのがこのメカニズムによる(純水は、電気があまり通らない)。
次に非金属の結合の共有結合を説明する。
共有結合
基本的な結合の説明の最後となる共有結合は、各原子で電子を共有して電子殻を閉殻する結合である。
具体的に共有結合の説明の前に電子の特性を説明すると、電子は基本的に2つで一つの組み合わせをつくり安定する性質がある。
つまり電子の挙動は、電子殻を満席にするのと同時に必ずペアになろうとする挙動を示す。
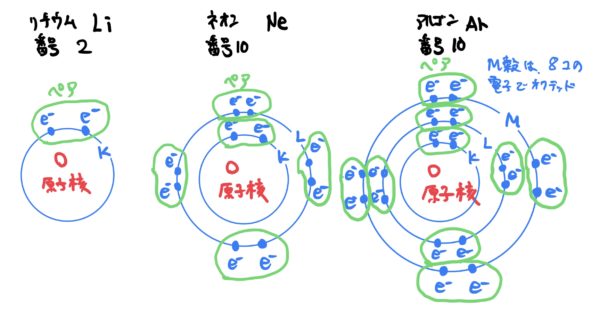
各原子がイオン状態になろうとする時に余所とやり取りする電子が他の原子の電子とペア(2個)になりかつ電子殻が閉殻するために電子を共有する。
この電子を共有しようとする力で結合することを共有結合と呼ぶ。
このときに発生する力は、かなり強大で強固な結合になる。
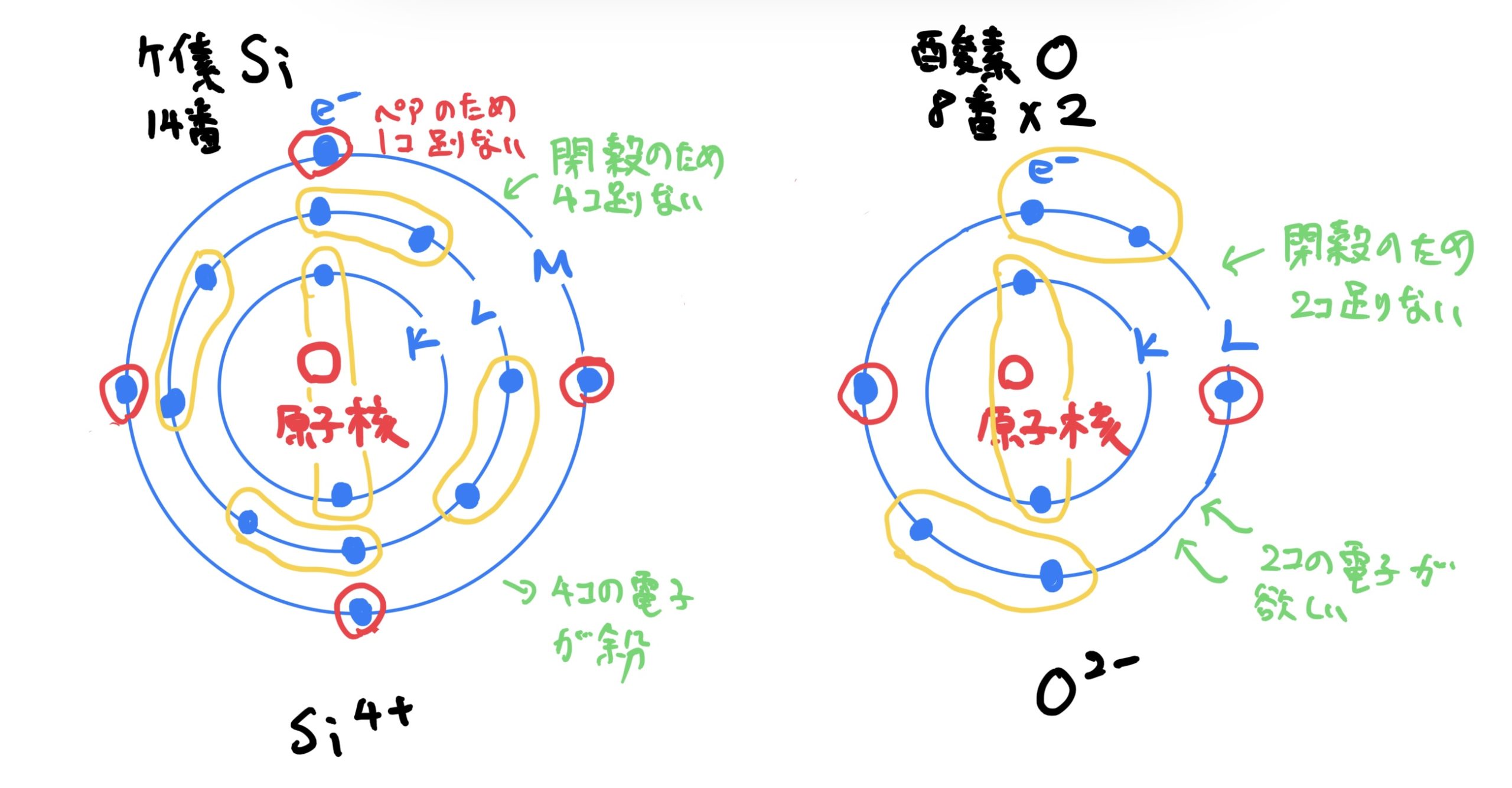
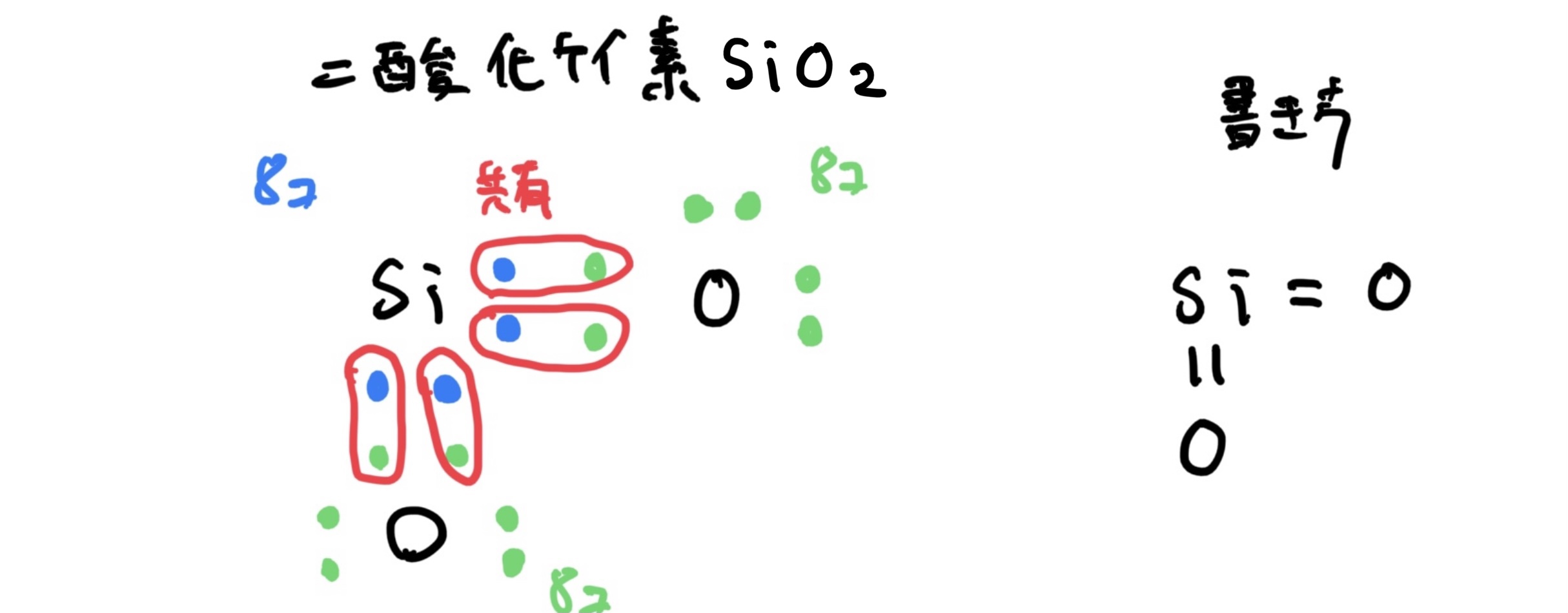
例としては非金属同士の結合でケイ素Si(原子番号14)と酸素O(原子番号8)でそれぞれイオン状態になるとケイ素は$ Si^{4+} $で酸素は$ O^{2-} $となる。
このときに酸素原子が一つだけだとケイ素原子の電子殻のM殻が安定するために必要な電子(オクテッドより8個で安定)の数が足りないので酸素原子を2個用意する。
そうすると閉殻するためにけケイ素原子と酸素原子の電子がペアになりかつ各原子の電子殻が閉殻するために電子を共有して2酸化ケイ素SiO2になる。
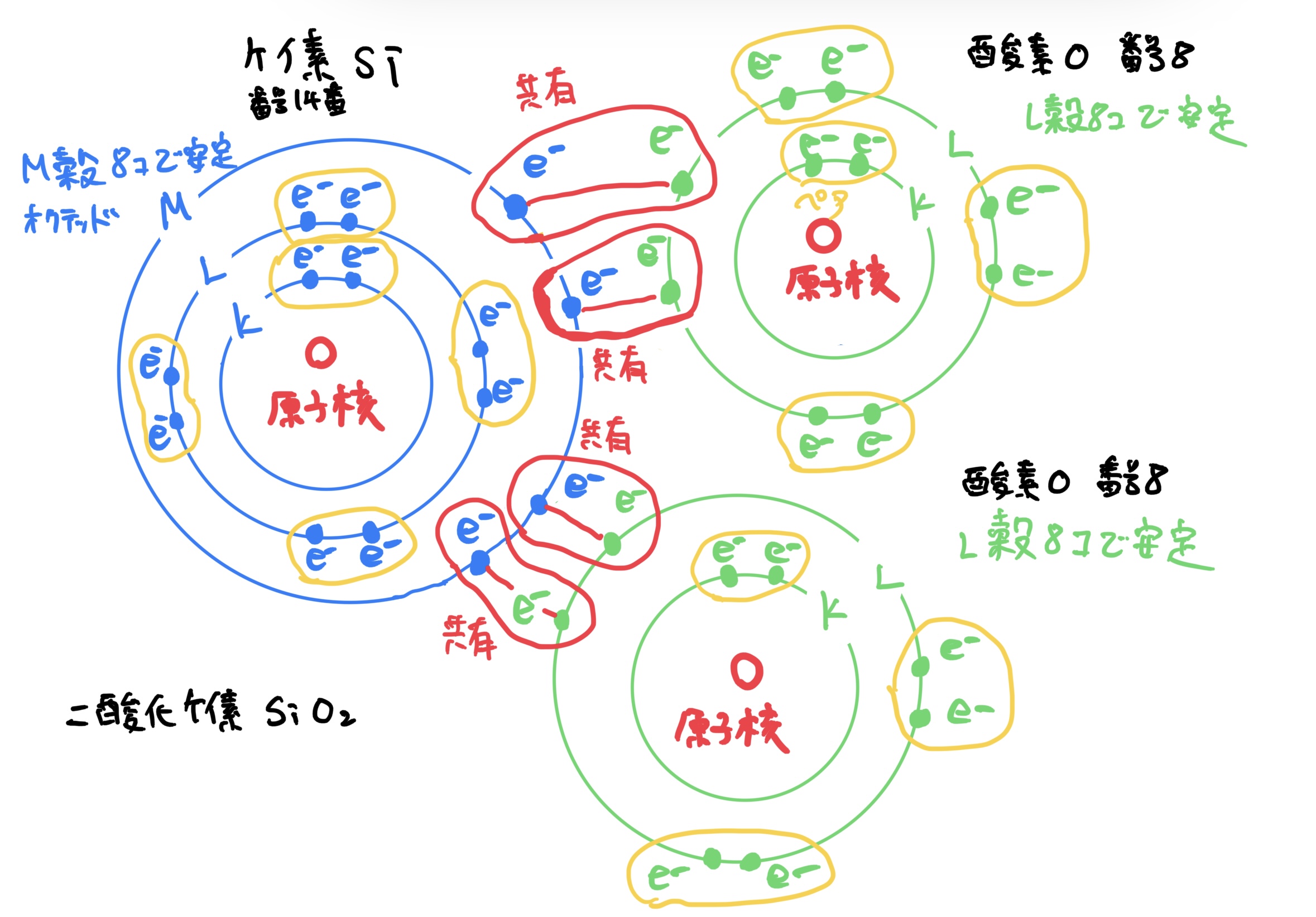
この物質は皆さんもよく知っているガラスの代表になる。
ちなみに毎回、原子の電子を全て描いていたら大変なので科学の世界では一番外側の電子殻の電子以外は省略して次のように描く。

共有結合の場合は、ペアで電子を共有するので結合状態は次のように表す。
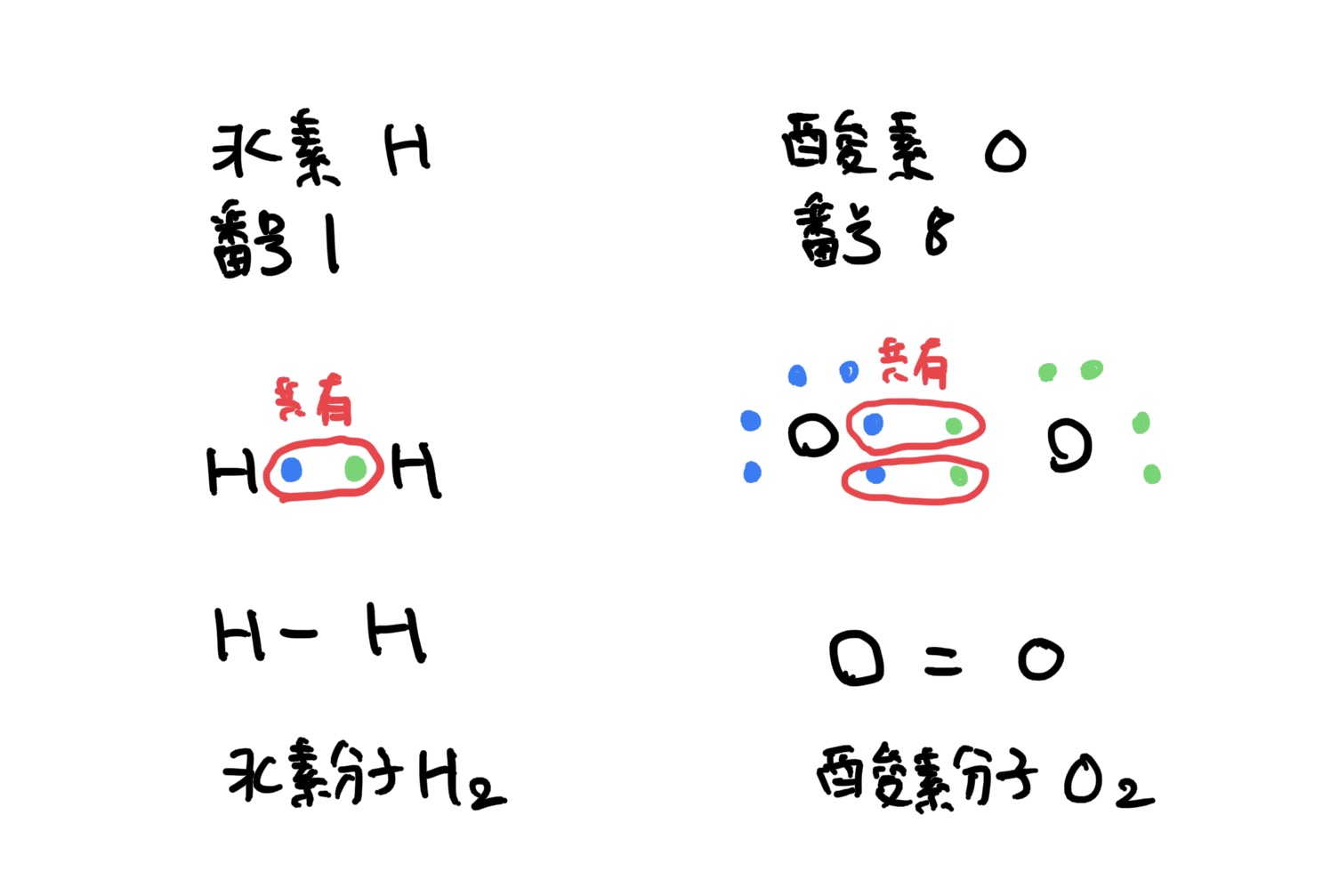
共有結合の他の代表的な分子は水素H2、酸素O2などが次のような共有結合として描くことができる。
共有結合の特徴
この共有結合の特徴としては、強固な結合のためとても硬くて強度が強い物質になりやすい。
また、その強固な結合により融点も高い。
その代わりに電子はガッチリと共有され動きづらいので導電性や熱伝導性はよくない。
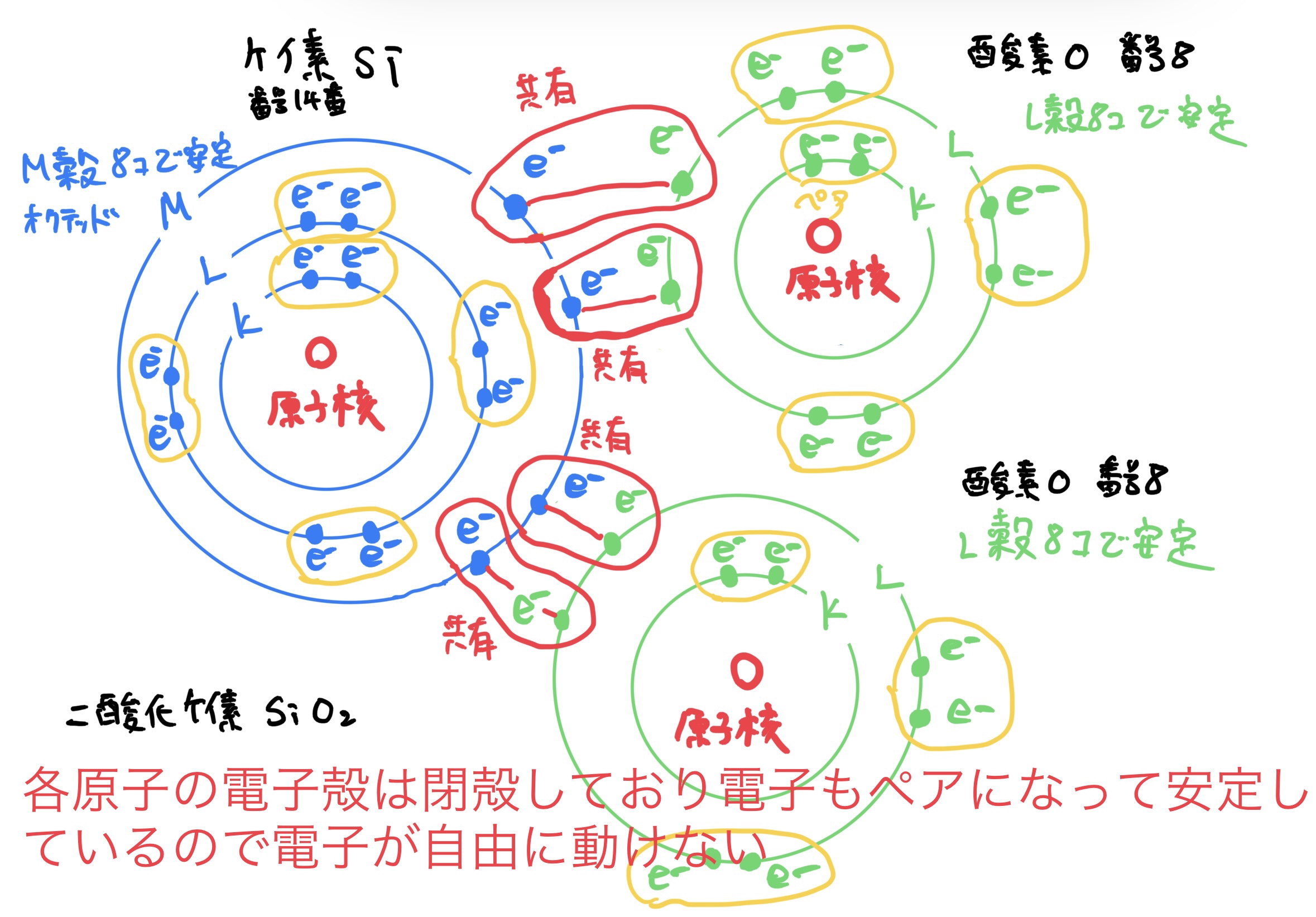
また強固な結合の代わりに金属結合のような再結合性の良さがないので脆い物質が多い。
ガラスなんかは、この特徴をよく表していて硬くて強い代わりにすぐ割れたりして脆いのは皆もよく知っていると思う。
さらにガラスは電気を通さないし熱伝導性もよくないことから逆に断熱材として使う場合もある(寒い地域用の2重ガラス窓など)。
ただしセラミックやケイ素を適切に加工すると電気を流したり流さなかったりする特殊な特性を持つ半導体になる。
これは現代社会を支えている重要な特性になる。
最後に原子同士の結合ではないが重要な分子同士を結合する分子結合を紹介する。
分子結合
これから説明する分子結合は、名前の通り分子と分子をくっつける結合のことだ。
この分子結合は、よくこれまで紹介してきた金属結合、イオン結合、共有結合と同列で説明されることが多いのだが、実は全く異なる形態の結合になる。
筆者も高校時代に大きく勘違いさせられたのだが金属結合、イオン結合、共有結合は原子と原子の結合のことに対して、分子結合は原子が結合した分子同士を結合させることである。
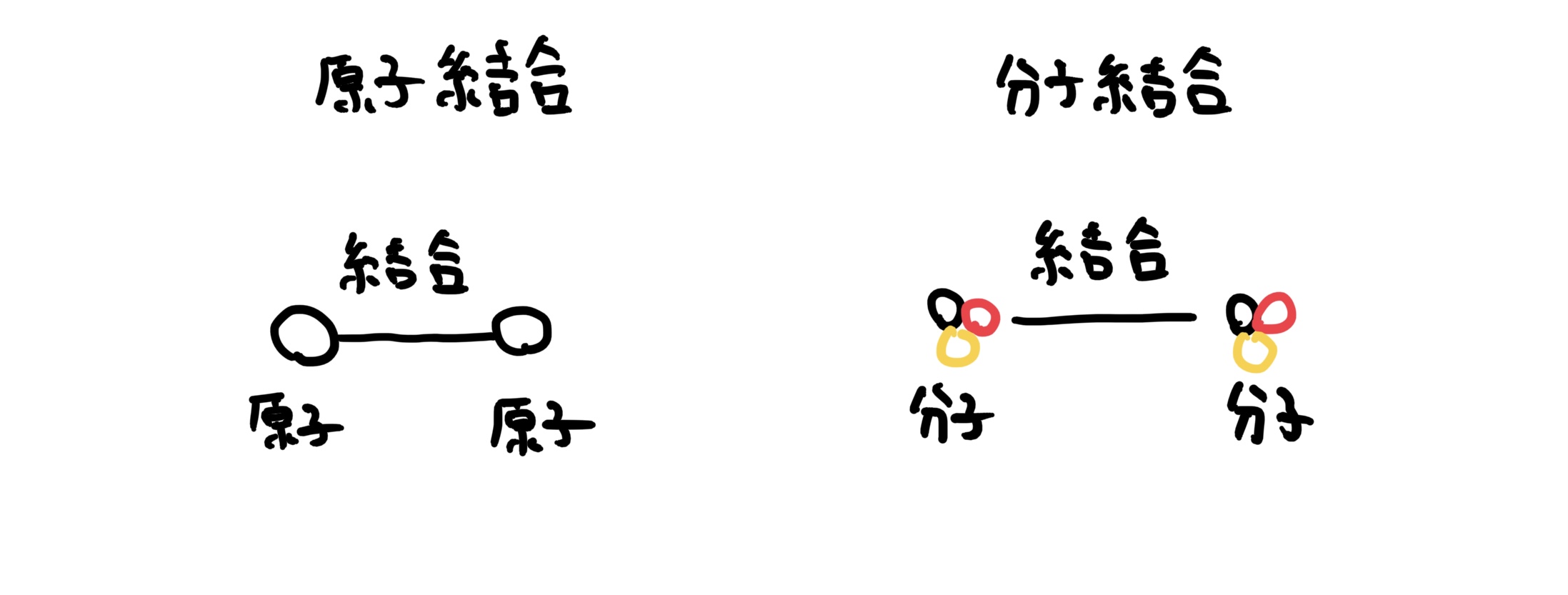
ここは、かなりの要注意ポイントで分子間結合は扱う物質が原子ではなく分子であることに注意だ。
では、具体的に分子結合を説明していく。
これまで説明してきたイオン結合、共有結合のいずれも原子と原子が電子のやりとりを行なって結合していることを説明してきた。
つまり電子のやりとりが適切に行われた結果、原子と原子の結合状態である分子は電気的に釣り合っていることになる。
しかしながら、その分子を注意深く観察すると分子は全体で電気的に釣り合っているが細かく見ると局所的に電気の偏りが存在している。
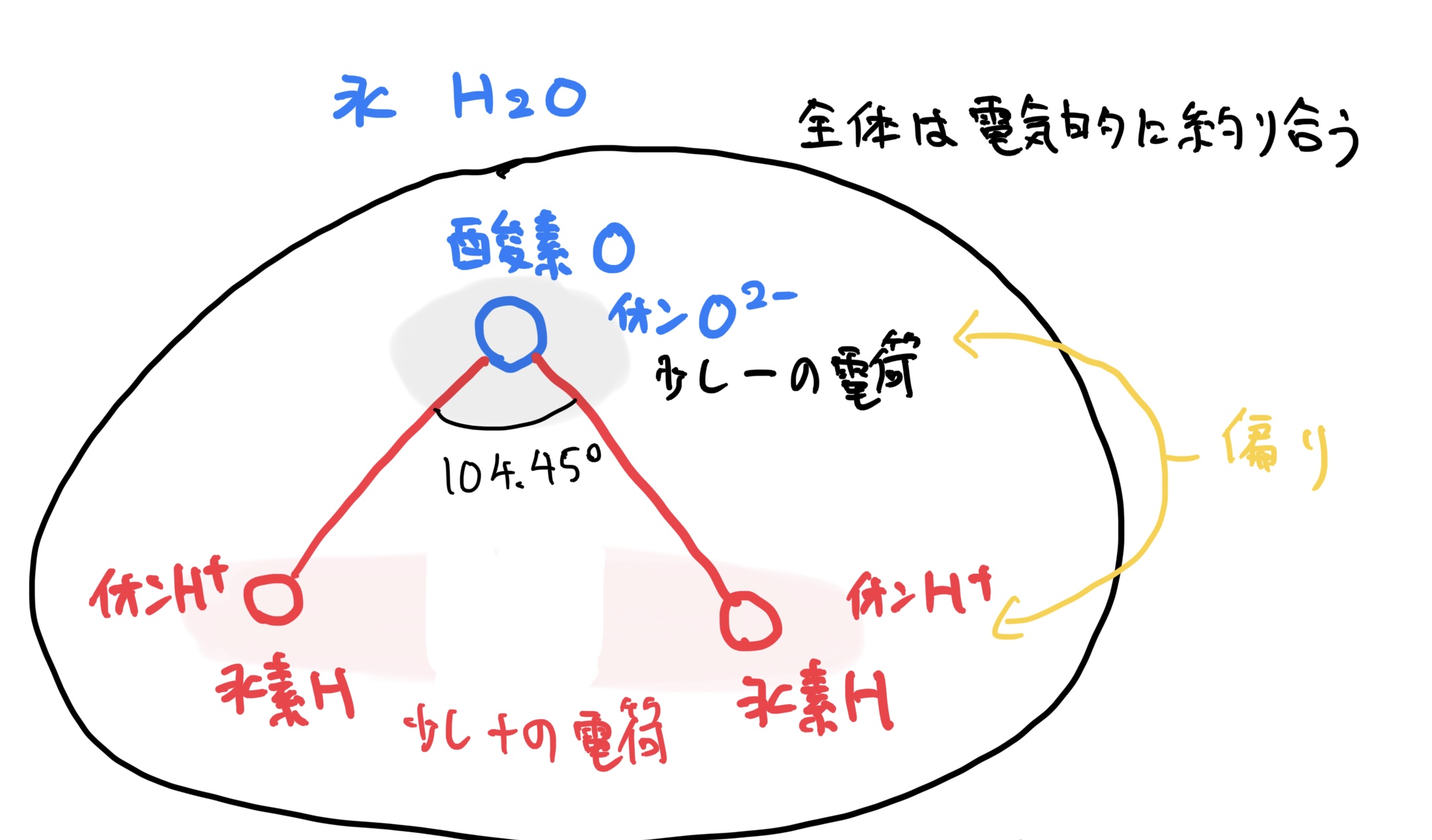
水であるH2Oを例に見ると、これは非金属原子同士の結合で基本的に共有結合で結びついて全体としては電気的に釣り合っている。
しかしながら、もっと細かく見てみると酸素Oと水素Hが結合する角度が104.45°の角度を持っており図のような非対称な平面構造になっている。
この時に電子の偏りをみると水素Hが2個付いている方向に+の電荷が偏り酸素が付いている方向にーの電荷の偏りが発生している(全体では釣り合っている)。
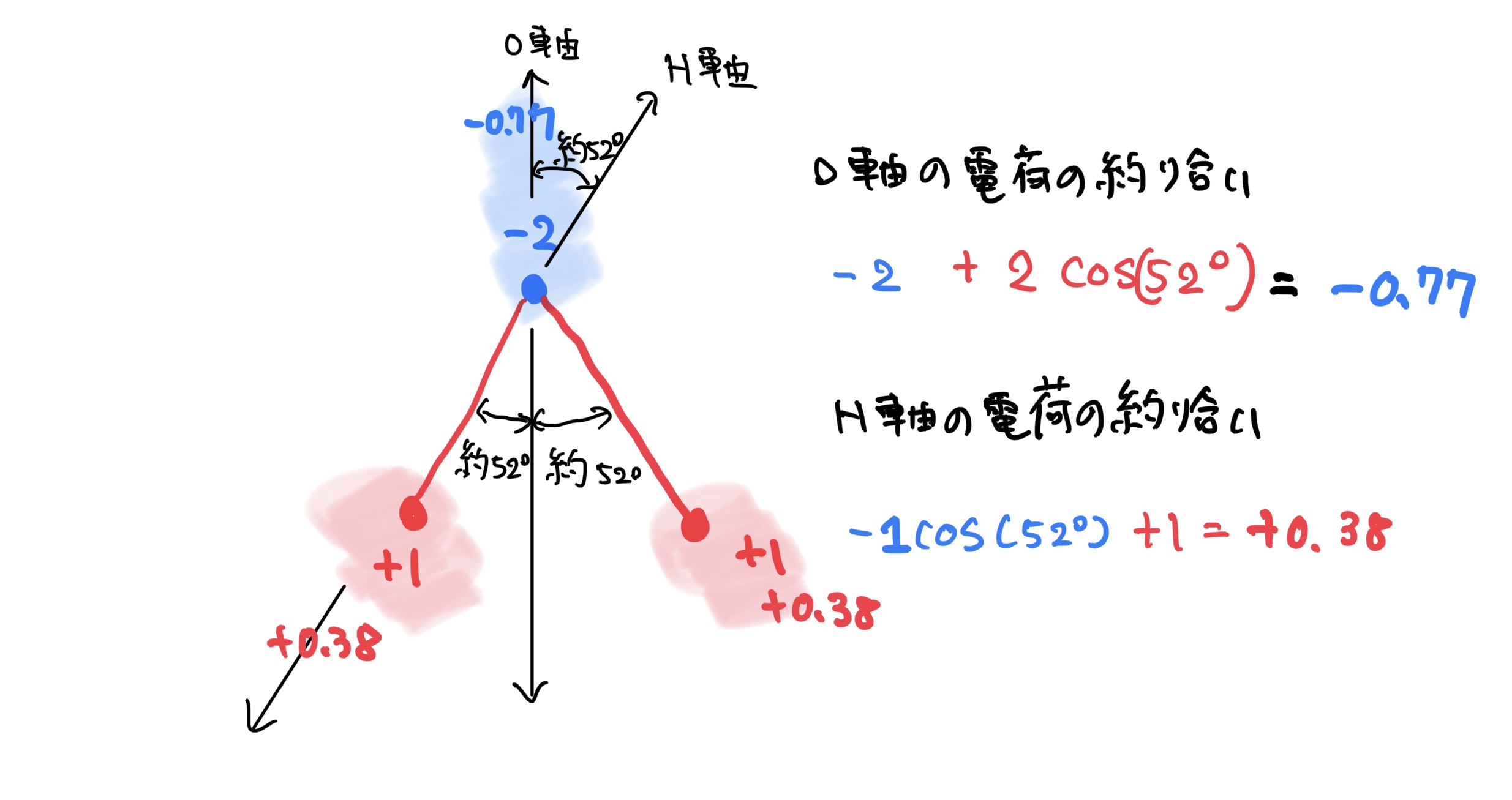
この水分子にさらに水分子を近づけるとお互いそれぞれが電荷の偏りを持っていることによって局所的に電気の釣り合いによる結合が発生するのだ(静電気力による結合)。
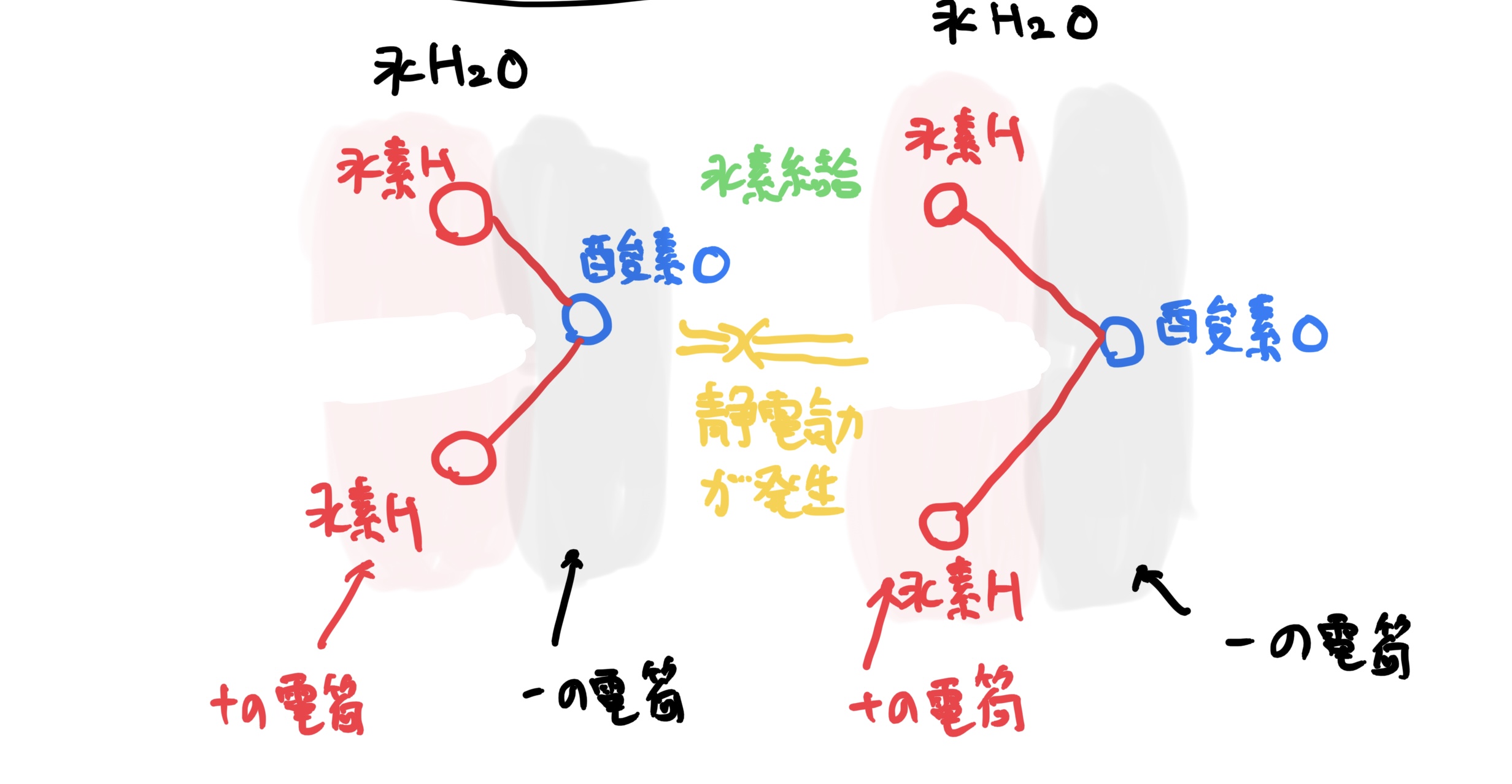
こんな感じで多くの水分子が結合することによって皆さんがよく知っている物体としての水を構成しているのだ。
このような結合を分子結合と呼び、さらに水のような水素によって電荷の偏りが発生し結合するタイプを水素結合と呼ぶ。
水のような分子として電気的な偏りを持っている分子を極性分子と呼び、逆に偏りがない分子を無極性分子と呼ぶ。
無極性分子の代表は、2酸化炭素CO2などだ。

この無極性分子の特徴としては、水素結合が発生しないので水のような溶媒(液体)に溶けにくい性質を持つ。
実際の身近な例としては、炭酸水がわかりやすくて無理やり2酸化炭素を水に溶かしているが容器を開ければすぐに炭酸(2酸化炭素)が抜けていくのは多くの人が体験しているはずだ(ビールが泡を吹き続けている現象)。
この水素結合以外にも、分子内に電気の偏りが発生して結合する物質がある。
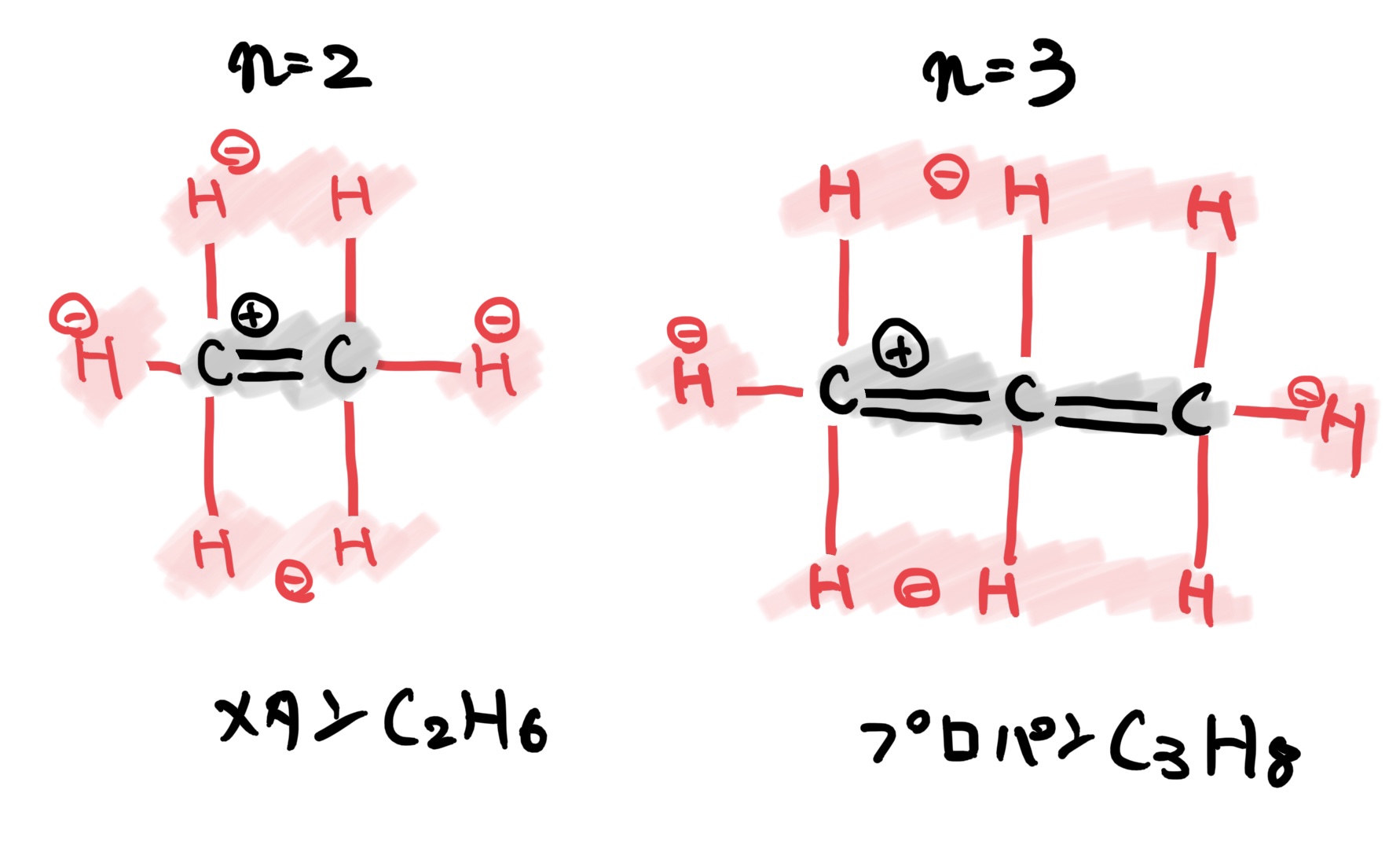
あまり聞き慣れないかもしれないが典型例として炭化水素(CnH2nやCnH2n+2、nは自然数)などに発生する。
これはかなり身近な物質で、機械材料講座の2回目で説明した有機材料の基本的な構成物質になる。
例えばCnH2n+2系のn=1の時はCH4でエタンでC2H6はメタン、C3H8はプロパンになる。
エタンはあまり聞き慣れない物質だと思うが、メタンはオナラの主成分だしプロパンは燃焼ガスとしてかなり多くの人が利用しているはずだ。
例としてこの3つの物質の結合状態を平面図で描くと次の図のようになる。
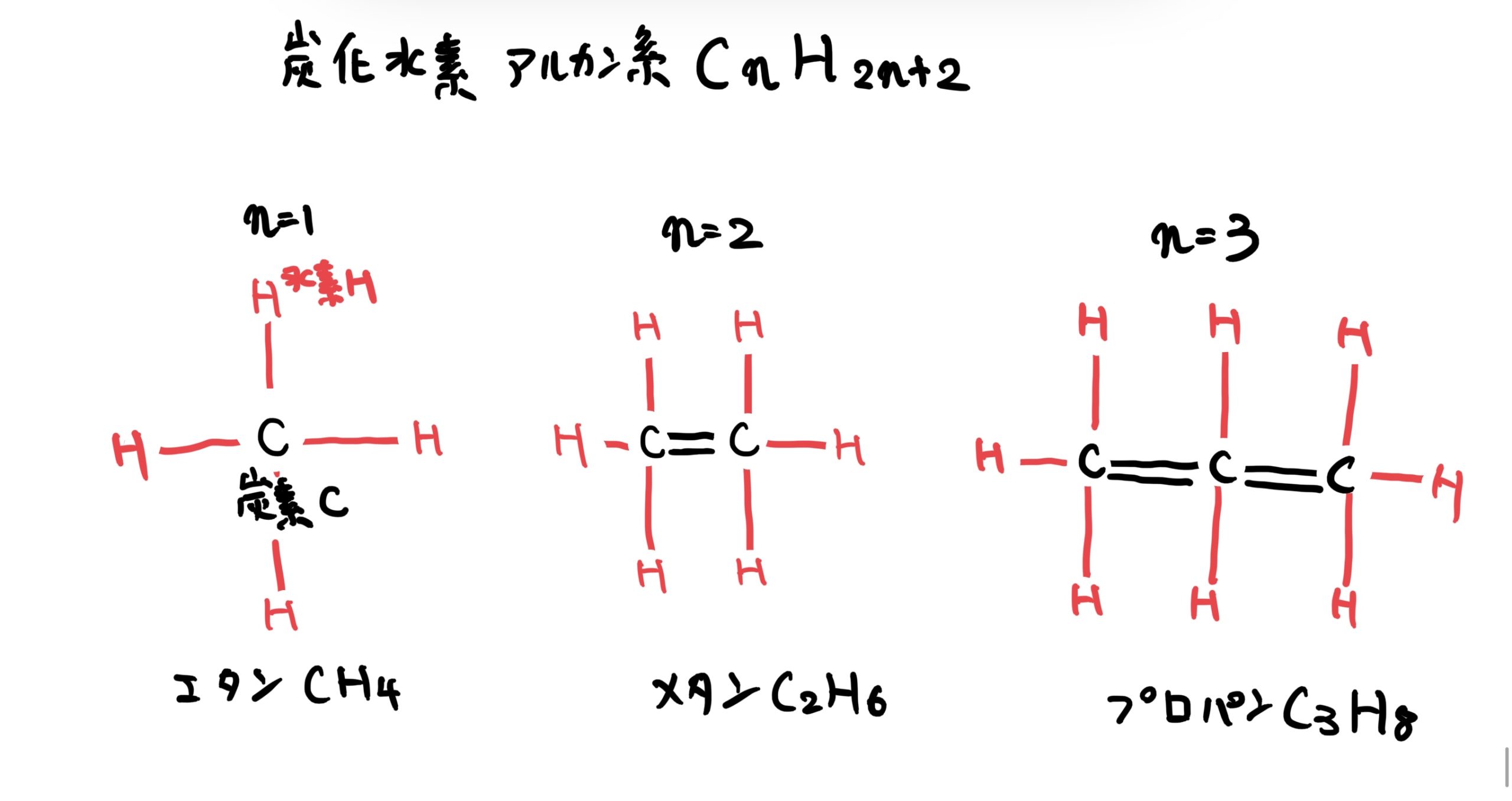
この図から全体では電気的に釣り合っているものの細かくみると電気が偏っているので分子結合が発生する。
このような有機材料が数多く集まって結合したものの一部を高分子(ポリマー)と呼び、皆さんがよく知っているプラスチックなどになる。
ここまでが分子結合のメカニズムでここから分子結合の特徴を説明する。
分子結合の特徴
分子結合は、基本的には電気的釣り合いが取れている分子の中の電気の偏りによって発生する静電気力によって結合するのであまり大きな力による結合ではない。
単純にちょっとした電気の偏りなので静電気力(+と−の差が小さい)が比較的に弱いのだ。
ただし、いくら電気的な偏りが少なくても分子を構成している原子の数が膨大になると、その膨大な数によって電気手的な偏りが大きくなる。
例えば例のエタンCH4だと構成原子は5つだが極端に構成原子が多いイプシルC20H82だと102個にもなり分子内の電気の偏りも大きくなる。
電気内の偏りが大きくなれば静電気力も大きくなるので分子結合の力も大きくなるのだ。
つまり構成原子の数によって結合力が変化するのが特徴だ(構成原子が多いほど結合は強い)。
以上で代表的な結合の説明を終わりにする。
まとめ
かなり長い内容になってしまったがまとめていこう。
・原子と原子の結合には主に3種類の結合がある。
・金属原子同士を結合するのが金属結合
・非金属原子と金属原子の結合に多いイオン結合
・非金属原子同士を結合するのに多い共有結合
・それぞれの結合力の強さは、共有結合>イオン結合>金属結合
になる。
次にそれぞれの結合の特徴をまとめると
・再結合性が良いため非常に延性に優れる
・自由電子が存在するため非常に導電性、熱伝導性が高い
・自由電子によって特定の波長の光を反射するため光沢がある色になっている
・分子自体の導電性はよくないが、水のような水溶液に溶けると導電性が高い
・電子をお互いの原子が共有して電子殻を閉殻するのでとても強固な結合になる
・結合が強固なので非常に硬くて強い物質になるが脆い
・強固な結合のため融点が高い
・基本的に導電性、熱電動性は良くない
・結合させる原子によっては電気を通したり通さなかったりする半導体になる
ここまでが原子と原子の結合のまとめになる。
次に原子が結合してできた分子同士の結合をまとめる。
・分子と分子の結合を分子結合と呼ぶ
・分子結合は、基本的に分子内の電気的な偏りによって静電気力によって結合される
・水素による電気的な偏りによって結合することを水素結合と呼ぶ
・分子結合の結合力は、原子間の結合力に比較してとても弱い
・分子結合の結合力は、分子の構成原子の数が増加するほど大きくなる
となる。
少し長くなってしまったがここまでが原子の結合、分子の結合の説明になる。
今回の内容は、高校化学の序盤でよく暗記させられる内容だが、暗記ではなく各結合のメカニズムを理解して欲しい。
結合のメカニズムがわかれば自ずと各結合の特徴も理解できるようになる。
具体的に機械設計の現場で起きるのが暗記に頼ると摺動部品に金属結合である同型金属の組み合わせを選択してしまい、再結合性の良さから作動中に熱でくっついてしまうのだ。
他にも導電性を考慮しないで材質を選択すると雨などによって機械に水が付着した時に勝手に電気が流れて腐食してしまうことがある。

このように意外と今回の内容は、実践の機械設計の材質選びのベースになる重要な内容になるので是非、理解して欲しい。
今回は高校の化学で学ぶ4種の結合である金属結合、イオン結合、共有結合、分子結合の基本を説明した。しかしながら機械材料では金属を頻繁に扱うので金属結合が非常に重要になってくる。
なので次回はいよいよ機械材料らしくなる金属結合のメカニズム、特徴を掘り下げていく。
基本的に本内容の教科書は存在せず筆者オリジナルだが筆者が学生から使っている教科書を紹介する。
もう一点、機械設計で必須の本があるので紹介しよう。
はっきり言って中身は不親切極まりないのだがちょっと忘れた時に辞書みたいに使える。このブログを見てくれれば内容が理解できるようになって使いこなせるはずだ。
またよく使う規格が載っているので重宝する。JISで定められて機械材料の特性が載っている。
多くの人が持っていると思うが持っていない人はちょっとお高いが是非、手に入れて欲しい。但し新品は高いので中古で購入を考えている方は表面荒さの項目が新JIS対応になっているのを確認することを強くオススメする。
さらにオススメしたいのがアマゾン キンドル アンリミテッドだ。アンリミテッドだと数多の本が月会費だけで読める(漫画〜専門書まで幅が広い)。
しかも流石、本屋が原点であるAmazonだけあって機械工学の専門書がそこそこ揃っていてかなり使えるサービスだ。
特に機械工学の専門書は高額になることが多いので少しだけ読みたい分野の本を眺めるのに非常に役に立つので是非、オススメしたい。
また本ブログをキッカケとしてエンジニアとしてステップアップして大きな仕事を掴む手段の一つとして転職するのも一つの手だ。
やはり予算の大きい機械設計、規模が大きい機械設計、大きな仕事をする場合は日本においては大手に入って仕事をする方がチャンスの機会が多いと思う。
私も最終的に転職はしていないが自分の将来を模索していた時期に転職活動をしていくつか内定を頂いたことがある。
折角なのでその経験(機械設計者の転職活動)を共有できるように記事に起こしたので参考にして頂ければ幸いだ。





コメント